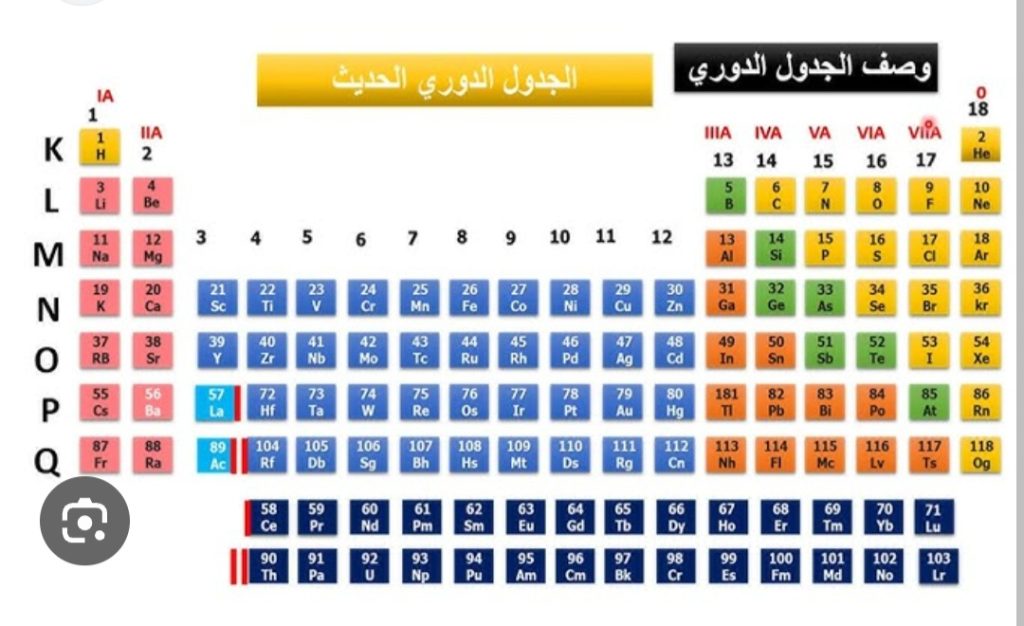
جدول مندليف الجدول الدوري.وتوضع العناصر بالأعمدة والصفوف
جدول مندليف الجدول الدوري
الجدول الدوري ( جدول مندليف):
مخطط يستخدم لتنظيم العناصر على أساس العدد الذري
الجدول الدوري ترتيب مجدول للعناصر الكيميائية،
مرتبة حسب عددها الذري،
والتوزيع الإلكتروني، والخواص الكيميائية المتكررة، والذي يُظهر هيكله اتجاهات دورية.
بشكل عام، تكون العناصر في الصف واحد (الدورة) فلزات باتجاه اليسار، ولا فلزات باتجاه اليمين،
بحيث توضع العناصر التي لها سلوكيات كيميائية مماثلة في نفس العمود.
تسمى صفوف الجدول عادةً بالدورات وتسمى الأعمدة بالمجموعات.
وتمتلك ستة مجموعات أسماء بالإضافة إلى الأرقام المخصصة: على سبيل المثال،
عناصر المجموعة 17 هي الهالوجينات؛ والمجموعة 18 هي الغازات النبيلة.
كما أنه يُعرض في شكل أربع مناطق مستطيلة بسيطة أو مستويات فرعية مرتبطة بملء المدارات الذرية المختلفة.
يمكن استخدام تنظيم الجدول الدوري لاشتقاق العلاقات بين خواص العناصر المختلفة،
وأيضًا الخصائص والسلوكيات الكيميائية المتوقعة للعناصر غير المكتشفة أو المركَّبة حديثًا.
كان الكيميائي الروسي ديمتري مندلييف أول من نشر جدولًا دوريًا معروفًا في عام 1869م،
وقد تم تطويره بشكل أساسي لتوضيح الاتجاهات الدورية للعناصر المعروفة آنذاك.
كما توقع بعض خصائص العناصر غير المحددة التي كان من المتوقع أن تملأ الفجوات داخل الجدول.
ثبتت صحة معظم توقعاته.
وقد تم توسيع فكرة مندلييف ببطء وصقلها مع اكتشاف أو توليف عناصر جديدة أخرى وتطوير نماذج نظرية جديدة لشرح السلوك الكيميائي.
يوفر الجدول الدوري الحديث الآن إطارًا مفيدًا لتحليل التفاعلات الكيميائية،
ولا يزال يستخدم على نطاق واسع في الكيمياء، والفيزياء النووية، والعلوم الأخرى.
تم اكتشاف أو تركيب جميع العناصر من العدد الذري 1 (هيدروجين) إلى 118 (أوغانيسون)،
واستكمال الصفوف السبعة الأولى من الجدول الدوري. توجد العناصر الـ 98 الأولى في الطبيعة،
على الرغم من أن بعضها موجود فقط بكميات شحيحة وأن البعض الآخر تم تصنيعه في المختبرات قبل أن يتم العثور عليه في الطبيعة.
تم تركيب العناصر 99 إلى 118 فقط في المختبرات أو المفاعلات النووية.
ويجري حاليًا متابعة تجميع العناصر التي تحتوي على أعداد ذرية أعلى: تبدأ هذه العناصر في الصف الثامن،
وقد اقترح العمل النظري مرشحين محتملين لهذا التمديد.
كما أُنتجت العديد من النويدات المشعة الاصطناعية من العناصر الطبيعية في المختبرات.
******
جدول مندليف
كان ديمتري مندليف حاول تصنيف العناصر من خلال ملاحظاته:
ان بعض العناصر لها خاصية كيميائية وفيزيائية متشابهة.
وهذا التشابه اعتبره مندليف المفتاح للكشف عن النماذج الخفية في العناصر.
فبدأ بكتابة بطاقات عليها العناصر والحقائق الثابتة والمعروفة عنها.
وجعل لكل عنصر بطاقة دون عليها درجة الانصهار والكثافة واللون والوزن الذري لذرة كل عنصر والقوة الترابطية له.
وعدد الروابط التي يستطيع العنصر تكوينها. ولما فرغ مندليف من تدوين البطاقات حاول تصنيفها بعدة طرق.
وأخيرا لاحظ أن ثمة نماذج بدت له من خلال ترتيب هذه العناصر حسب الزيادة في الكتلة الذرية atomic mass أو الوزن الذري.
فلاحظ أن القوة الترابطية the bonding power للعناصر من الليثيوم lithium حتى الفلورين fluorine تغيرت بطريقة مرتبة.
فمثلا بعد الفلورين fluorine نجد العنصر الأثقل الصوديوم الذي له نفس القوة الترابطية كالليثيوم.
لهذا رتب مندليف بطاقة الصوديوم تحت بطاقة الليثيوم.
وهذا معناه في جدول مندليف أن العنصر له نفس الخاصية كالعنصر الذي فوقه أو العنصر الذي تحته.
ورغم هذا لم يكن جدول مندليف كاملا أو دقيقا.
لأن ترتيب العناصر به حسب تزايد الكتلة(الوزن) الذرية atomic mass لكل عنصر،
خلف 3 فراغات بجدوله
وقال مندليف أن هذه الفراغات ستملآ بعناصر لم تكتشف بعد.
ومن خلال موقعها في جدوله استطاع أن يبين خواصها.
ونشر جدول مندليف عام 1869م.
ومعنى كلمة دوري “periodic” أن أنماطا من خواص العناصر متكررة في كل صف.
وبعد 16 سنة من نشر جدول مندليف استطاع الكيميائيون اكتشاف العناصر الثلاثة المفقودة من الجدول
وهي اسكانيديوم scandium وجاليوم gallium وجرمانيوم germanium.
وكانت خواصها تشبه ما ذكره مندليف عنها.
فالجدول الدوري نجده جدولا للعناصر الكيماوية مرتبة لتبين خواصها الكيمائية والفيزيائية.
غير أن عناصر كالكلورين والحديد والنحاس مواد كيماوية أساسية لا تتكسر بالتفاعلات الكيماوية.
عكس المركبات الكيماوية التي تتكون من عدة عناصر.
فالجدول الدوري وسيلة لترتيب العناصر المعروفة حتى العناصر التي لم تكتشف بعد.
حقيقة العناصر المتشابهة في الخواص توضع في نفس المجموعة بالجدول الدوري.
*******
معرض الصور:


******
المراجع والمصادر:
مواقع إجتماعية- فيس بوك – مجموعة أعمال التصميم
بالطبع
بصورة شاملة
إما
أينما
حيثما
كيفما
أيما
أيّما
بينما
ألّا
لئلّا
حبّذا
سيّما
لكن
بالتالي
هكذا
أو
أم
لذلك
مثلا
تحديدا
عموما
لاسيما
خصوصا
بالأخص
خاصة
بالمثل
لأن
بسبب
إذا
عندما
حين